bihar board class 10 science notes | रासायनिक अभिक्रियाएँ
bihar board class 10 science notes | रासायनिक अभिक्रियाएँ
क्रियाकलाप 1.1
सावधानी : इस क्रियाकलाप में शिक्षक के सहयोग की आवश्यकता है। सुरक्षा के लिए
छात्र आँखों पर चश्मा पहन लें तो उचित होगा।
लगभग 2 cm लंबे मैग्नीशियम रिबन को रेगमाल से रगड़कर साफ कर लीजिए।
इसे चिमटे से पकड़कर स्पिरिट लैंप या बर्नर से इसका दुहन करें तथा इससे बनी राख को
वॉच ग्लास में इकट्ठा कर लीजिए जैसा कि चित्र 1.1 में दिखाया गया है। मैग्नीशियम रिबन का
दहन करते समय इसे अपनी आँखों से यथासंभव दूर रखिए।

चित्र 1.1 मैग्नीशियम रिबन का वायु में दहन कर मैग्नीशियम ऑक्साइड
को वॉच ग्लास में इकट्ठा करना
प्रश्न-आपने क्या प्रेक्षण किया ?
उत्तर-हम प्रेक्षण करते हैं कि मैग्नीशियम रिबन एक चमकदार श्वेत लौ के साथ जलती
है तथा श्वेत चूर्ण में परिवर्तित हो जाती है। यह चूर्ण मैग्नीशियम ऑक्साइड है। यह वायु में
उपस्थित ऑक्सीजन तथा मैग्नीशियम के बीच होने वाली अभिक्रिया के कारण बनता है।
क्रियाकलाप 1.2
● एक परखनली में लेड (सीसा) नाइट्रेट का घोल लीजिए।
● इसमें पोटैशियम आयोडाइड का घोल मिला दीजिए।
प्रश्न 1. आपने क्या प्रेक्षण किया ?
उत्तर-हम प्रेक्षण करते हैं कि दोनों ही पदार्थ आपस में अभिक्रिया करते हैं तथा निम्नलिखित
अभिक्रिया संपादित होती है:
Pb(NO3)2 + 2KI→ 2KNO3 + PbI2
क्रियाकलाप 1.3
● एक शंक्वाकार फ्लास्क या परखनली में जस्ते के कुछ दाने लीजिए।
● इसमें तनु हाइड्रोक्लोरिक अम्ल या सल्फ्यूरिक अम्ल मिला. दीजिए (चित्र 1.2)
सावधानी-अम्ल का इस्तेमाल सावधानी से कीजिए।
प्रश्न 1. क्या जस्ते के दानों के आसपास कुछ होता दिखाई दे रहा है ?
उत्तर-हाँ, जस्ते के दानों का आकार धीरे-धीरे घटता जा रहा है तथा एक गैस का निर्माण
हो रहा है जो हाइड्रोजन है।
प्रश्न 2. शंक्वाकार फ्लास्क या परखनली को स्पर्श कीजिए। क्या इसके तापमान में
कोई परिवर्तन हुआ है?
उत्तर-हाँ, इसका तापमान थोड़ा-सा बढ़ गया है।
परिणाम : उपरोक्त तीन क्रियाकलापों के
आधार पर हम कह सकते हैं कि निम्नलिखित किसी
भी प्रेक्षण से हम निर्धारित कर सकते हैं कि एक
रासायनिक अभिक्रिया हुई है-
अवस्था में परिवर्तन
• रंग में परिवर्तन
• गैस का निकास/उत्सर्जन
• तापमान में परिवर्तन

चित्र 1.2 जस्ते पर तनु सल्फ्यूरिक अम्ल की अभिक्रिया से
हाइड्रोजन गैस का निर्माण
पाठगत प्रश्नोत्तर
प्रश्न 1. वायु में जलाने से पहले मैग्नीशियम रिबन को साफ क्यों किया जाता है ?
उत्तर-वायु में जलाने से पहले मैग्नीशियम रिबन को इसलिए साफ किया जाता है कि इसकी
ऊपरी सतह हट जाए, साथ ही धूलकण आदि भी साफ हो जाएँ ताकि मैग्नीशियम की सतह हवा
के प्रत्यक्ष सम्पर्क में आ सके।
प्रश्न 2. निम्नलिखित रासायनिक अभिक्रियाओं के लिए संतुलित समीकरण लिखिए :
(i) हाइड्रोजन + क्लोरीन → हाइड्रोजन क्लोराइड
(ii) बेरियम क्लोराइड + ऐलुमिनियम सल्फेट → बेरियम सल्फेट + ऐलुमिनियम क्लोराइड
(iii) सोडियम + जल → सोडियम हाइड्रॉक्साइड + हाइड्रोजन
‘उत्तर-(i) H2 + Cl2 → 2HCI (ii) 3BaCl2 + AI2(SO4)3 → 3Baso4 + 2AICI3
(iii) 2Na+2H2O-2NaOH+H2
प्रश्न 3. निम्नलिखित अभिक्रियाओं के लिए उनकी अवस्था के संकेतों के साथ
संतुलित रासायनिक समीकरण लिखें :
(i) जल में बेरियम क्लोराइड तथा सोडियम सल्फेट का घोल अभिक्रिया करके सोडियम
क्लोराइड का घोल तथा अघुलनशील बेरियम सल्फेट बनाता है।
(ii) सोडियम हाइड्रॉक्साइड का विलयन (जल में) हाइड्रोक्लोरिक अम्ल के विलयन
(जल में) से अभिक्रिया करके सोडियम क्लोराइड का विलयन तथा जल बनाते हैं।
उत्तर-(i) BaCl2(1) + Na2so4(aq)→ Baso4(s) + 2NaCl (1)
(ii) NaOH (aq) + HCI (aq) – NaCl (1) + H2O (1)
पाठगत प्रश्नोत्तर
प्रश्न 1. किसी पदार्थ ‘X’ के विलयन का उपयोग सफेदी करने के लिए होता है।
(i). पदार्थ ‘x’ का नाम तथा इसका सूत्र लिखिए।
(ii) ऊपर (i) में लिखे पदार्थ ‘X’ की जल के साथ अभिक्रिया लिखिए।
उत्तर-(i) पदार्थः ‘X’ चूना है जिसका उपयोग सफेदी करने के लिए होता है। इसका
रासायनिक सूत्र CaO है।
(ii) CaO + H2O→Ca(OH)2
प्रश्न 2. क्रियाकलाप 1.7 में एक परखनली में एकत्रित गैस की मात्रा दूसरी से दोगुनी
क्यों है ? उस गैस का नाम बताइए।
उत्तर-परखनली में एकत्रित गैस की मात्रा दोगुनी इसलिए है क्योंकि इसमें हाइड्रोजन गैस
है जबकि दूसरी परखनली में ऑक्सीजन है। ये दोनों गैसें जल के विद्युत अपघटन के कारण निर्मित होती है। जल में हाइड्रोजन की मात्रा ऑक्सीजन से दूनी होती है।
क्रियाकलाप 1.4
• एक बीकर में थोड़ा कैल्सियम ऑक्साइड लीजिए।
• इसमें धीरे-धीरे जल मिलाइए।
• अब बीकर को स्पर्श कीजिए जैसे चित्र 1.3 में दिखाया गया है।
प्रश्न-क्या इसके ताप में कोई परिवर्तन हुआ ?
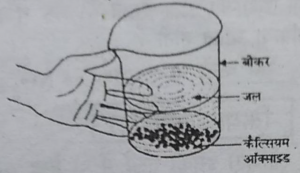
चित्र 1.3 जल के साथ कैल्सियम ऑक्साइड की अभिक्रिया से बुझे हुए चूने का निर्माण
उत्तर-हाँ, इसका तापमान बहुत अधिक बढ़ गया है। निम्नलिखित अभिक्रिया बीकर में
घटित होती है
CaO+H2O→ Ca(OH)2 + ऊष्मा
क्रियाकलाप 1.5
• एक शुष्क क्वथन नली में 2 ग्राम फेरस सल्फेट
के क्रिस्टल लीजिए।
• फेरस सल्फेट के क्रिस्टल के रंग पर ध्यान
दीजिए।
• क्वथन नली को बर्नर या स्पिरिट लैंप की ज्वाला
पर गर्म करें, जैसा चित्र 1.4 में दिखाया
गया है।
• गर्म करने के पश्चात् क्रिस्टल के रंग को
देखिए।

चित्र 1.4 फेरस सल्फेट क्रिस्टल वाली परखनली
को गर्म करने तथा गंध सूंघने की सही विधि
प्रश्न-गर्म करने से पहले फेरस सल्फेट के क्रिस्टल के रंग पर ध्यान दीजिए। गर्म करने
के बाद फेरस सल्फेट के क्रिस्टल के रंग का निरीक्षण कीजिए।
उत्तर-गर्म करने से पहले फेरस सल्फेट के क्रिस्टल का रंग हरा होता है जबकि गर्म करने
पर इसका रंग गायब हो जाता है।
2FeSO4 गर्म करने पर →Fe2O3 + SO2 + SO3
क्रियाकलाप 1.6
• एक क्वथन नली में 2 g लेड नाइट्रेट का चूर्ण लीजिए।
• चिमटे से क्वथन नली को पकड़कर ज्वाला के ऊपर रखकर इसे गर्म कीजिए जैसा,
चित्र 1.5 में दिखाया गया है।

चित्र 1.5 लेड नाइट्रेट को तापन देना तथा नाइट्रोजन डाइऑक्साइड का उत्सर्जन
प्रश्न-आपने क्या देखा ? यदि कोई परिवर्तन है तो उसे नोट कर लीजिए।
उत्तर-हम भूरे रंग का धुआँ उत्सर्जित होता देखते हैं। यह धुआँ नाइट्रोजन डाइऑक्साइड
(NO2) का है। निम्नलिखित अभिक्रिया घटित होती है :
2Pb(NO3)2 गर्म करने पर―2PbO + NO2+O2
क्रियाकलाप 1.7
• एक प्लास्टिक का मग लीजिए। इसकी तली में दो छिद्र करके उनमें रबड़ का डॉट
लगा दीजिए। इन छिद्रों में कार्बन इलेक्ट्रोड डाल दीजिए। जैसा कि चित्र 1.6 में दिखाया
गया है।
• इन इलेक्ट्रोडों को 6 वोल्ट की बैटरी से जोड़ दीजिए।
• मग में इतना जल डालें कि इलेक्ट्रोड उसमें डूब जाएँ। जल में तनु सल्फ्यूरिक अम्ल
की कुछ बूंँदें डाल दीजिए।
• जल से भरी दो अंशांकित परखनलियों को दोनों कार्बन इलेक्ट्रोडों के ऊपर उल्टा करके
रख दीजिए।
• अब विद्युत धारा प्रवाहित करके इस उपकरण को थोड़ी देर के लिए छोड़ दीजिए।
• दोनों इलेक्ट्रोडों पर आप बुलबुले बनते हुए देखेंगे। ये बुलबुले अंशांकित नली से जल
को विस्थापित कर देते हैं।

चित्र 1.6 जल का वैद्युत अपघटन
प्रश्न 1. क्या दोनों परखनलियों में एकत्रित गैस का आयतन समान है ?
उत्तर-नहीं, दोनों परखनलियों में एकत्रित गैस का आयतन समान नहीं है।
• जब दोनों परखनलियाँ गैस से भर जाएँ तब उन्हें सावधानीपूर्वक हटा लीजिए।
• एक जलती हुई मोमबत्ती को दोनों परखनलियों के मुंँह के ऊपर लाकर इन गैसों की
जाँच कीजिए।
सावधानी : इस. चरण को शिक्षक द्वारा सावधानीपूर्वक किया जाना चाहिए।
प्रश्न 2. दोनों स्थितियों में क्या होता है ?
उत्तर-एक परखनली में गैस का आयतन, दूसरी परखनली में गैस के आयतन का दोगुना है।
प्रश्न 3. दोनों परखनलियों में कौन-सी गैस उपस्थित है ?
उत्तर-एक परखनली में हाइड्रोजन गैस उपस्थित है जबकि दूसरी परखनली में ऑक्सीजन
गैस उपस्थित है।
क्रियाकलाप 1.8
चायना डिश में 2g सिल्वर क्लोराइड लीजिए।
इस चायना डिश को थोड़ी देर के लिए सूर्य के प्रकाश में रख दीजिए।
प्रश्न 1. इसका रंग क्या है ?
उत्तर-यह उजले रंग का है।
प्रश्न 2. थोड़ी देर पश्चात सिल्वर क्लोराइड के रंग को देखिए।
उत्तर-सिल्वर क्लोराइड का उजला रंग सूर्य
के प्रकाश में धूसर रंग का हो जाता है। ऐसा प्रकाश
द्वारा सिल्वर क्लोराइड के सिल्वर तथा क्लोरीन में
विघटित होने के कारण होता है।
सूर्य का
2AgCI—————–2Ag + Cl2
प्रकाश
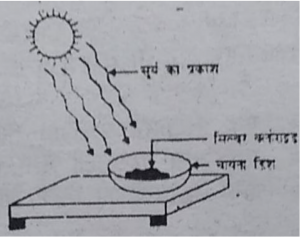
चित्र 1.7 सूर्य के प्रकाश में सिल्वर क्लोराइड धूसर रंग का
होकर सिल्वर धातु बनाता है।
क्रियाकलाप 1.9
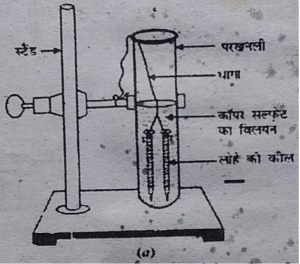
• लोहे की तीन कील लीजिए और उन्हें रेगमाल से रगड़कर साफ कीजिए।
• (A) तथा (B) से चिह्नित की हुई दो परखनलियाँ लीजिए। प्रत्येक परखनली में 10 ml
कॉपर सल्फेट का विलयन लीजिए।
• दो कीलों को धागे से बांधकर सावधानीपूर्वक परखनली (B) के कॉपर सल्फेट विलयन
में लगभग 20 मिनट तक डूबो कर रखिए। चित्र 1.8 (a)| तुलना करने के लिए एक
कील को अलग रखिए।
• 20 मिनट बाद दोनों कीलों को कॉपर सल्फट
के विलयन से बाहर निकाल लीजिए।
• परखनली (A) तथा (B) में कॉपर सल्फेट
के विलयन के नीले रंग की तीव्रता की तुलना
कीजिए। [चित्र 1.8 (b)]
• कॉपर सल्फेट के विलयन में डूबी कीलों के
रंग की तुलना बाहर रखी कील से कीजिए।
[चित्र 1.8(b)]
चित्र 1.8 (a)) कॉपर सल्फेट के विलयन में डूबी हुई, लोहे की कीलें

चित्र 1.8 (b) प्रयोग से पहले तथा उसके उपरांत लोहे की कील तथा
कॉपर सल्फेट विलयन की तुलना
प्रश्न 1. परखनली (A) में रखे कॉपर सल्फेट विलयन का रंग क्या है ?
उत्तर-नीला रंग।
प्रश्न 2. परखनली (B) में रखे कॉपर सल्फेट विलयन का रंग क्या है ?
उत्तर-परखनली (B) में रखे कॉपर सल्फेट विलयन का नीला रंग बहुत हल्का है।
प्रश्न 3. कॉपर सल्फेट विलयन का रंग क्यों बहुत हल्का है ?
उत्तर-विलयन से कॉपर के विस्थापन के कारण कॉपर सल्फेट विलयन का रंग बहुत हल्का है।
प्रश्न 4. परखनली (B) में रखी लोहे की कील का रंग क्या है ?
उत्तर-इसका रंग भूरा है।
प्रश्न 5. लोहे की कील का रंग भूरा क्यों हो जाता है ?
उत्तर-लोहे की कील का रंग लोहे के ऊपर कॉपर के जमा होने के कारण भूरा हो जाता है।
Cuso4 + Fe→ FeSO4 + Cu
क्रियाकलाप 1.10
• एक परखनली में 3ml सोडियम सल्फेट का विलयन लीजिए।
• एक अन्य परखनली में 3ml बेरियम क्लोराइड लीजिए।
• दोनों विलयनों को मिला लीजिए। (चित्र 1.9)।

चित्र 1.9 बेरियम सल्फेट तथा सोडियम क्लोराइड का निर्माण
प्रश्न-आप क्या देखते हैं जब सोडियम सल्फेट तथा बेरियम क्लोराइड को मिलाया
जाता है?
उत्तर-हम देखते हैं कि उजले रंग का एक पदार्थ (BaSO4) बनता है जो जल में
अघुलनशील है।
Na2SO4 + BaCl2 → 2NaCl + BaSO4
क्रियाकलाप 1.11
• चायना डिश में 1g कॉपर चूर्ण लेकर उसे गर्म कीजिए (चित्र 1.10)।
प्रश्न-आपने क्या देखा ?
उत्तर-हम देखते हैं कि कॉपर चूर्ण की सतह
कॉपर (II) ऑक्साइड की परत जमने के कारण काली
पड़ जाती है। यह कॉपर चूर्ण का ऑक्सीजन के साथ
अभिक्रिया के कारण बनता है।
2Cu+O2 गर्म करने पर→ 2CuO
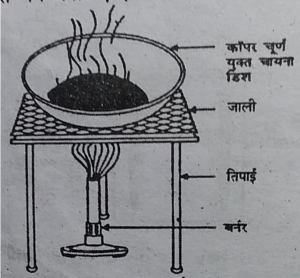
चित्र 1.10 कॉपर का कॉपर ऑक्साइड में उपचयन
पाठगत प्रश्नोत्तर
प्रश्न 1. जब लोहे की कील को कॉपर सल्फेट के विलयन में डुबोया जाता है तो
विलयन का रंग क्यों बदल जाता है ?
उत्तर-जब लोहे की कील को कॉपर सल्फेट के विलयन में डुबोया जाता है तो विलयन
का रंग बदल जाता है क्योंकि लोहे द्वारा कॉपर के विस्थापन के कारण लौह सल्फेट का निर्माण
होता है।
CuSO4 (aq) + Fe→ FeSO4 + Cu
प्रश्न 2. क्रियाकलाप 1.10 से भिन्न द्विविस्थापन अभिक्रिया का एक उदाहरण दीजिए।
उत्तर-जब लेड (II) नाइट्रेट पोटैशियम आयोडाइड के साथ मिलाया जाता है तो पोटैशियम
नाइट्रेट तथा लेड आयोडाइड का निर्माण होता है।
Pb(NO3)2 + 2KI→ 2KNO3 + Pbl2
प्रश्न 3. निम्न अभिक्रियाओं में उपचयित तथा अपचयित पदार्थों की पहचान कीजिए:
(i) 4Na (s)+O2(g)- 2Na2O(s)
(ii) CuO (s) + H2(g)→ Cu(s) + H2O(1)
उत्तर-(i) सोडियम (Na) Na2O में उपचयित होता है।
(ii) Cuo (कॉपर ऑक्साइड) Cu में अवकृत होता है जबकि H2 (हाइड्रोजन) जल
(H2O) में उपचयित होता है।
अभ्यास
प्रश्न 1. नीचे दी गयी अभिक्रिया के संबंध में कौन-सा कथन असत्य है ?
2Pb0 (s) + C (s)→ 2Pb(s) + CO2(s)
(a) सीसा अपचयित हो रहा है।
(b) कार्बन डाइऑक्साइड उपचयित हो रहा है।
(c) कार्बन उपचयित हो रहा है।
(d) लेड ऑक्साइड अपचयित हो रहा है।
(i) (a) एवं (b) (ii) (a) एवं (c) (iii) (a), (b) एवं (c) (iv) सभी
उत्तर-(i) (a) एवं (b)
प्रश्न 2. Fe2O3 +2AI → AI2O3+2Fe
ऊपर दी गयी अभिक्रिया किस प्रकार की है ?
(a) संयोजन अभिक्रिया (b) द्विविस्थापन अभिक्रिया
(c) वियोजन अभिक्रिया (d) विस्थापन अभिक्रिया
उत्तर-(d) विस्थापन अभिक्रिया।
प्रश्न 3. लौह-चूर्ण पर तनु हाइड्रोक्लोरिक अम्ल डालने से क्या होता है ? सही उत्तर
पर निशान लगाइए।
(a) हाइड्रोजन गैस एवं आयरन क्लोराइड बनता है।
(b) क्लोरीन गैस एवं आयरन हाइड्रॉक्साइड बनता है।
(c) कोई अभिक्रिया नहीं होती है।
(d) आयरन लवण एवं जल बनता है।
उत्तर-(a) हाइड्रोजन गैस एवं आयरन क्लोराइड बनता है।
प्रश्न 4. संतुलित रासायनिक समीकरण क्या है ? रासायनिक समीकरण को संतुलित
करना क्यों आवश्यक है?
उत्तर-जब किसी रासायनिक समीकरण में विभिन्न तत्वों के परमाणुओं की संख्या दोनों
तरफ बराबर होती है तो उसे संतुलित रासायनिक समीकरण कहते हैं। रासायनिक समीकरण को
संतुलित करना इसलिए आवश्यक है क्योंकि इसके द्वारा हम न केवल समीकरण की वास्तविक
जानकारी प्राप्त कर सकते हैं बल्कि अभिकारकों एवं उत्पादों की वास्तविक संख्या की जानकारी
भी प्राप्त कर सकते हैं।
प्रश्न 5. निम्न कथनों को रासायनिक समीकरण के रूप में अनुवाद कर उन्हें संतुलित
कीजिए।
(a) नाइट्रोजन हाइड्रोजन गैस से संयोग करके अमोनिया बनाती है।
(b) हाइड्रोजन सल्फाइड गैस का वायु में वहन होने पर जल एवं सल्फर डाइऑक्साइड
बनता है।
(c) ऐलुमिनियम सल्फेट के साथ अभिक्रिया करके बेरियम क्लोराइड, ऐलुमिनियम
क्लोराइड एवं बेरियम सल्फेट का अवक्षेप प्रदान करता है।
(d) पोटैशियम धातु जल के साथ अभिक्रिया करके पोटैशियम हाइड्रॉक्साइड एवं
हाइड्रोजन गैस प्रदान करता है।
उत्तर-(a)N2(g) + 3H2(g)→ 2NH3(g)
(b) 2H2S (g) + 302(g) →2H2O (l) + 2SO2(g)
(c) 3BaCl2 + AI2(SO4)3→3BaSO4 +2AICI3
(d) 2K + 2H2O→ 2KOH + H2(g)
प्रश्न 6. निम्न रासायनिक समीकरणों को संतुलिन कीजिए :
(a) HNO3 + Ca(OH)2 → Ca(NO3)2 +H2O
(b) NaOH + H2SO4 Na2SO4 +H2O
(c) NaCl + AgNO3→ AgCl + NaNO3
(d) BaCl2 +H2SO4 → BaSO4 +HCl
उत्तर-(a) 2HNO3 + Ca(OH)2 → Ca(NO3)2 + 2H2O
(b) 2NaOH + H2SO4→ Na2SO4 + 2H2O
(c)NaCI + AgNO3 → AgCl + NaNO3
(d)BaCl2 +H2SO4 → BaSO4 + 2HCl
प्रश्न 7. निम्न अभिक्रियाओं के लिए संतुलित रासायनिक समीकरण लिखिए. :
(a) कैल्सियम हाइड्रॉक्साइड + कार्बन डाइ-ऑक्साइड, कैल्सियम कार्बोनेट + जल
(b) जिंक + सिल्वर नाइट्रेट → जिंक नाइट्रेट + सिल्वर
(c) ऐलुमिनियम + कॉपर क्लोराइड → ऐलुमिनियम क्लोराइड + कॉपर
(d) बेरियम क्लोराइड + पोटैशियम सल्फेट – बेरियम सल्फेट + पोटैशियम क्लोराइड
उत्तर-(a) Ca(OH)2 + CO2 → CaCO3 + H2O (b) Zn + 2AgNO3→Zn(NO3)2 + 2Ag
(c) 2AI + 3CuCl2 2AICI3 +3Cu(d) BaCl2 +K2SO4→BaSO4 + 2KCI
प्रश्न 8, निम्न अभिक्रियाओं के लिए संतुलित रासायनिक समीकरण लिखें एवं प्रत्येक
अभिक्रिया का प्रकार बताइए।
(a) पोटैशियम ब्रोमाइड (aq) + बेरियम आयोडाइड (aq) → पोटैशियम आयोडाइड
(aq) + बेरियम ब्रोमाइंड (s)
(b) जिंक कार्बोनेट (s)= जिंक ऑक्साइड (s) + कार्बन डाइऑक्साइड (g)
(c) हाइड्रोजन (g) + क्लोरीन (g) → हाइड्रोजन क्लोराइड (g)
(d) मैग्नीशियम (s) + हाइड्रोक्लोरिक अम्ल (aq) मैग्नीशियम क्लोराइड (aq) +
हाइड्रोजन (g)
उत्तर-(a) 2KBr(aq) + Bal2(aq)→ 2KI(aq) + BaBr2(aq)
(b) ZnCO3 (s) →ZnO (s) + CO2(g)
(c) H2(g) + CI2(g)- 2HCI (g)
(d) Mg(s) + 2HCl (aq) – MgCl2 + H2(g) .
अभिक्रिया का प्रकार-
(a) द्विविघटन
(b) विघटन
(c) संयोजन
(d) विस्थापन
प्रश्न 9. ऊष्माक्षेपी एवं ऊष्माशोषी अभिक्रिया का क्या अर्थ है ? उदाहरण दीजिए।
उत्तर-ऊष्माक्षेपी अभिक्रिया-वे अभिक्रियाएँ जिनमें ऊर्जा मुक्त होती है उन्हें ऊष्माक्षेपी
अभिक्रिया कहते हैं।
उदाहरण-
1. सभी संयोजन अभिक्रियाएँ
CH4 + 2O2 →CO2 + 2H2O + ऊष्मा
2. थर्माइट अभिक्रिया
2AI+ Fe2O3→ 2Fe+ AI2O3+ ऊष्मा
ऊष्माशोषी अभिक्रिया-वे अभिक्रियाएँ जिनमें ऊर्जा अवशोषित होती है उन्हें ऊष्माशोषी
अभिक्रिया कहते हैं।
CaCO3 गर्म करने पर → CaO + CO2
प्रश्न 10. श्वसन को ऊष्माक्षेपी अभिक्रिया क्यों कहते हैं ? वर्णन करें।
उत्तर-श्वसन के दौरान अंदर लिए गए ऑक्सीजन द्वारा भोजन विघटित होता है अर्थात्
वह उपचयित होता है। इस प्रक्रिया में ऊर्जा मुक्त होती है। अतः श्वसन को ऊष्माक्षेपी अभिक्रिया
कहते हैं।
C6H12O3 + 6O2 +6CO2 +6 H2O + ऊर्जा
प्रश्न 11. वियोजन अभिक्रिया को संयोजन अभिक्रिया के विपरीत क्यों कहा जाता
है ? इन अभिक्रियाओं के लिए समीकरण लिखें।
उत्तर-वियोजन अभिक्रियाएँ वे अभिक्रियाएँ हैं जिनमें कोई यौगिक दो या अधिक नये
यौगिकों में विघटित हो जाता है।
CaCO3 गर्म करने पर→ CaO + CO2
संयोजन अभिक्रियाएँ वे अभिक्रियाएँ हैं जिनमें दो पदार्थ आपस में संयोग करके एक नए
पदार्थ का निर्माण करते हैं।
CaO + CO2 →CaCO3
उपर्युक्त उदाहरणों में दोनों अभिक्रियाएँ समान हैं किन्तु विपरीत स्थितियाँ दिखा रही हैं।
अत: वियोजन अभिक्रियाओं को संयोजन अभिक्रियाओं के विपरीत कहा जाता है।
प्रश्न 12. उन वियोजन अभिक्रियाओं का एक-एक समीकरण लिखें जिनमें ऊष्मा,
प्रकाश एवं विद्युत के रूप में ऊर्जा प्रदान की जाती है।
उत्तर-ऊर्जा का ऊष्मा के रूप में प्रयोग हो रहा है।
CaCO3 ऊष्मा→CaO + CO2
ऊर्जा का प्रकाश के रूप में उपयोग हो रहा है।
2AgCI (s) प्रकाश ऊर्जा→2Ag(s) + CI2(g)
ऊर्जा का विद्युत के रूप में उपयोग हो रहा है।
2H2Oविद्युत →2H2 +O2 (जल का विद्युत अपघटन)
प्रश्न 13. विस्थापन एवं द्विविस्थापन अभिक्रियाओं में क्या अंतर है ? इन अभिक्रियाओं
के समीकरण लिखिए।
उत्तर-विस्थापन अभिक्रिया में किसी लवण से उसका एक तत्व किसी अपेक्षाकृत अधिक
क्रियाशील तत्त्व द्वारा विस्थापित हो जाता है। उदाहरण के लिए निम्नलिखित अभिक्रिया में CuSO4 से Cu, Zn द्वारा विस्थापित हो जाता है क्योंकि Zn अपेक्षाकृत अधिक अभिक्रियाशील है।
CuSO4 +Zn→ ZnSO4+Cu
द्विविस्थापन अभिक्रिया में एक नए उत्पादों के निर्माण के लिए दो अभिकारकों के बीच
आयनों का आदान-प्रदान होता है।
Na2SO4 (aq) + BaCl2(aq) → BaSO4 (s) + 2NaCI (aq)
प्रश्न 14. सिल्वर के शोधन में, सिल्वर नाइट्रेट के विलयन से सिल्वर प्राप्त करने
के लिए कॉपर धातु द्वारा विस्थापन किया जाता है। इस प्रक्रिया के लिए अभिक्रिया लिखिए।
उत्तर-जब सिल्वर नाइट्रेट के विलयन में कॉपर मिलाया जाता है तो यह सिल्वर को
विस्थापित कर देता है क्योंकि कॉपर सिल्वर से अधिक अभिक्रियाशील होता है।
2AgNO3 + Cu→ Cu(NO3)2 + Ag
प्रश्न 15. अवक्षेपण अभिक्रिया से आप क्या समझते हैं ? उदाहरण देकर समझाइए।
उत्तर-वह अभिक्रिया जिसमें किसी अवक्षेप का निर्माण होता है उसे अवक्षेपण अभिक्रिया
कहते हैं।
उदाहरण:
1. Na2SO4(aq) + BaCl2(aq) → BaSO4(s) + 2NaCl (aq)
अवक्षेप
2. Pb(NO3)2 + 2KI + 2KNO3 + Pbl2
प्रश्न 16. ऑक्सीजन के योग या हास के आधार पर निम्न पदों की व्याख्या करें।
प्रत्येक के लिए दो उदाहरण दें।
(a) उपचयन
(b) अपचयन
उत्तर-(a) उपचयन-वे अभिक्रियाएं जिनमें ऑक्सीजन का योग होता है उन्हें उपचयन
कहते हैं।
उदाहरण:
(i) 2Cu+O2→ 2CuO (ii) 2H2 +O2→ 2HO
(b) अपचयन-वे अभिक्रियाएँ जिनमें ऑक्सीजन का हास होता है उन्हें अपचयन कहते हैं।
उदाहरण:
(i)ZnO+C → Zn + CO (ii) Cuo+H2→Cu+H2O
प्रश्न 17. एक भूरे रंग का चमकदार तत्व ‘X’ को वायु की उपस्थिति में गर्म करने पर
वह काले रंग का हो जाता है। इस तत्व ‘X’ एवं उस काले रंग के यौगिक के नाम बताइए।
उत्तर-चमकदार भूरे रंग का तत्व ‘X’ कॉपर है। जब इसे हवा में गर्म किया जाता है या
कॉपर ऑक्साइड के जमा होने के कारण काला पड़ जाता है।
2Cu+O2 ऊष्मा→2CuO
भूरा रंग काला
प्रश्न 18. लोहे की वस्तुओं को हम क्यों पेन्ट करते हैं ?
उत्तर-लोहे की वस्तुओं को संक्षारण से बचाने के लिए हम पेन्ट करते हैं। पेन्ट, वस्तु की
सतह वथा हवा या नमी के बीच प्रत्यक्ष संपर्क को समाप्त कर देता है।
प्रश्न 10, तेल्वे एवं वसायुक्त खाद्य पदार्थ को नाइट्रोजन से युक्त क्यों किया जाता है ?
उत्तर-तेल एवं वसायुक्त खाद्य पदार्थ को क्षतिग्रस्त होने से बचाने के लिए उन्हें नाइट्रोजन
से युक्त किया जाता है। जब ऐसे पदार्थ हवा के संपर्क में आते हैं तो उपचयित होकर विकृत गंधित हो जाते हैं। उनके गंध तथा स्वाद बदल जाते हैं।
प्रश्न 20. निम्न पदों का वर्णन करें तथा प्रत्येक का एक-एक उदाहरण दीजिए :
(2) संक्षारण (b) विकृत गंधिता।
उत्तर-(a) संक्षारण-जब कोई धातु अपने आसपास अम्ल, नमी आदि के संपर्क में आती
है तब यह संक्षारित होती है और इस प्रक्रिया को संक्षारण कहते हैं।
संक्षारण के लिए परिस्थितियाँ :
(i) नमी (जल) की उपस्थिति।
(ii) वायु की उपस्थिति।
उदाहरण : लोहे में जंग लगना संक्षारण का एक सामान्य उदाहरण है।
(b) विकृत गंधिता : उपचयित होने पर तेल एवं वसा विकृतगंधी हो जाते हैं तथा उनके
स्वाद तथा गंध बदल जाते हैं। इस प्रक्रिया को विकृत गधिता कहते हैं।
उदाहरण : वसा एवं तेल से युक्त पदार्थ लंबी अवधि तक रखने पर क्षतिग्रस्त हो जाते
हैं तथा उनके स्वाद एवं गंध बदल जाते हैं।
◆◆◆
